Neurobiologie du cuivre et du zinc
Nous avons développé une méthode de nano-imagerie corrélative des métaux et des protéines par combinaison du rayonnement synchrotron (nano-XRF) et de la microscopie de super résolution STED. Cette méthode a permis de révéler que le Cu et le Zn sont impliqués dans la plasticité morphologique des synapses par interaction avec la tubuline et l’actine dans les neurones (Domart et al., 2020).
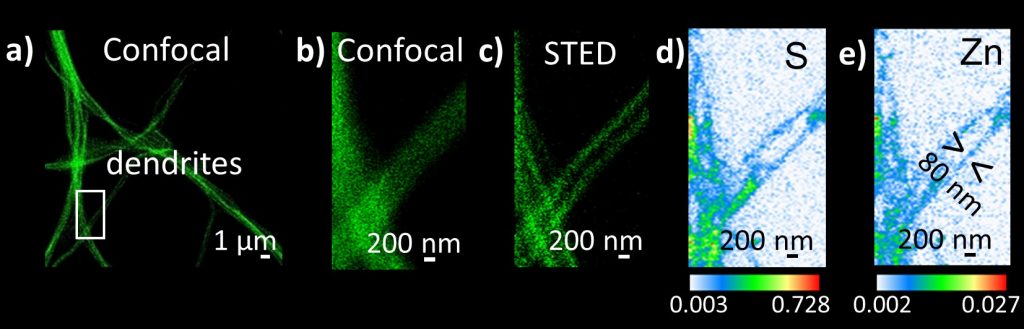
Imagerie corrélative de la tubuline (vert), du soufre et du zinc à haute résolution spatiale (40 nm). a) Microscopie confocale de la tubuline montrant les dendrites. b) Microscopie confocale de la région d’intérêt encadrée en a). c) Imagerie STED de la tubuline dans la même région d’intérêt montrant des filaments de tubuline parallèles et illustrant le pouvoir de résolution supérieur de la microscopie STED par rapport à la microscopie confocale. d-e) Cartes quantitatives de soufre et de zinc par nano-XRF (ng/cm2) de la région d’intérêt STED©RichardOrtega
NEUROTOXICOLOGIE DES MÉTAUX ENVIRONNEMENTAUX (e.g. MN, U)
Neurotoxicologie du manganèse
Le manganèse (Mn) est un métal essentiel mais neurotoxique à dose élevée, il peut provoquer des symptômes proches de ceux de la maladie de Parkinson. Nous avons étudié les mécanismes de neurotoxicité dans le contexte d’une protéine de transport du Mn, SLC30A10, dont des mutations sont responsables de formes familiales de syndromes parkinsoniens.
En combinant la microscopie de fluorescence optique des organites cellulaires avec la microscopie de fluorescence X induite par rayonnement synchrotron (nano-SXRF), nous avons montré une accumulation de Mn dans l’appareil de Golgi des cellules qui expriment la mutation pathologique SLC30A10-Δ105–107 (Carmona et al., 2019).
La maladie serait donc causée par une accumulation de Mn dans l’appareil de Golgi qui perturberait le transport vésiculaire. Ces travaux ont été complétés par la validation par nano-SXRF de la localisation du Mn dans l’appareil de Golgi également observée avec des fluorophores spécifiques du Mn (Das et al., 2019).
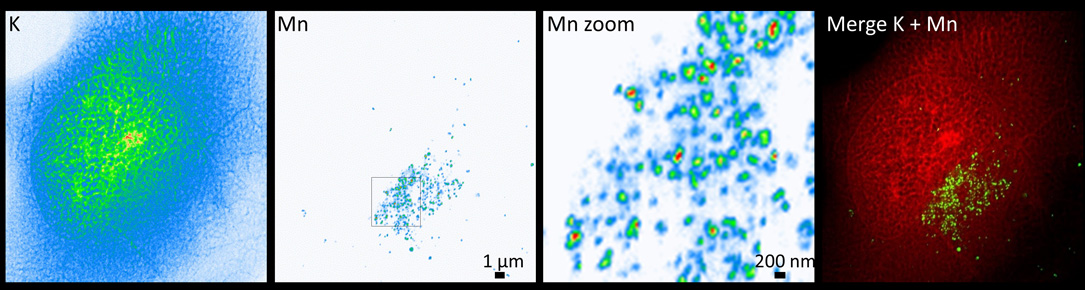
Identification de la distribution du manganèse (Mn) dans des vésicules de l’appareil de Golgi observée par nano-imagerie de fluorescence X sur la ligne de lumière ID16A de l’ESRF. Le potassium (K) est présent dans l’ensemble de la cellule tandis que le Mn s’accumule dans les vésicules de l’appareil de Golgi des cellules présentant une mutation pathologique de la protéine SLC30A10 (Carmona et al., 2019).©RichardOrtega
Neurotoxicologie de l’uranium
L’uranium (U) est un élément ubiquiste, entraînant une exposition de la population à de faibles concentrations. Quelle que soit la voie d’exposition, une faible quantité d’U atteint le cerveau et est associée chez l’animal à des effets neurologiques comme la perturbation du système dopaminergique.
Dans le cadre du programme national de Toxicologie Nucléaire nous avons étudié les mécanismes de neurotoxicité de l’U naturel, sur des cellules humaines dopaminergiques. Nous observons des effets neurotoxiques loin du seuil de cytotoxicité, comme l’inhibition du catabolisme de la dopamine (Carmona et al., 2018). Nous avons également révélé pour la première fois la distribution subcellulaire de l’U aux doses non cytotoxiques, grâce à l’imagerie de fluorescence X (XRF) par rayonnement synchrotron, montrant qu’environ 60% de l’U se retrouvait sous forme d’agrégats péri-nucléaires.
Nos résultats indiquent un nouveau mécanisme d’agrégation cytoplasmique de l’U qui serait impliqué dans la protection des neurones par séquestration de l’uranium en espèces insolubles, moins réactives. La fraction soluble restante d’uranium (40% de l’U cellulaire total) serait responsable de la liaison aux protéines et des effets neurotoxiques qui en résultent (Carmona et al., 2021).
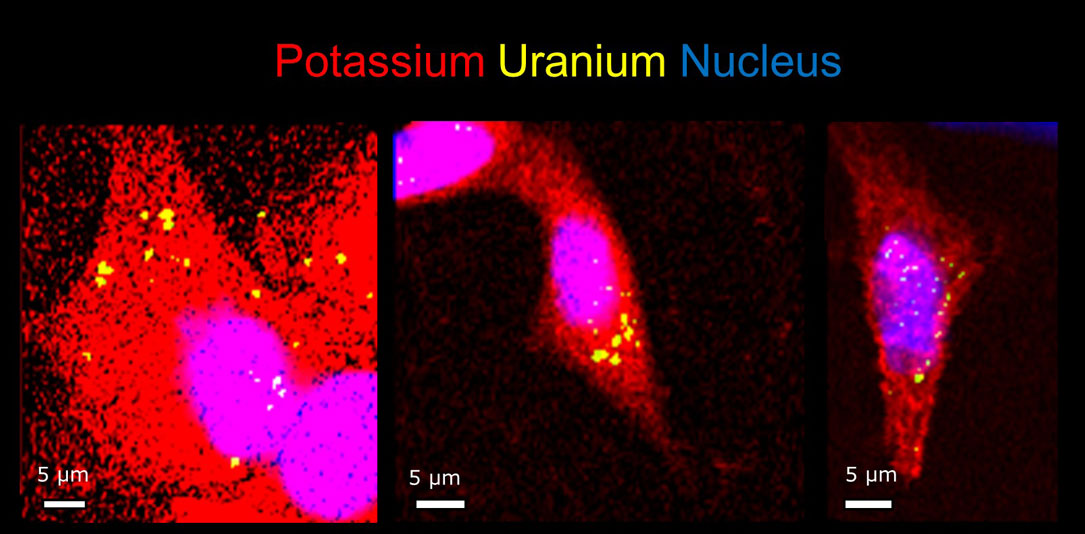
Imagerie synchrotron XRF (ligne de lumière Nanoscopium, SOLEIL) du potassium (en rouge), et de l’uranium (en jaune), et microscopie de fluorescence du noyau (en bleu), montrant l’agrégation péri-nucléaire de l’uranium dans les cellules dopaminergiques après exposition continue à de faibles doses d’uranium naturel soluble (Carmona et al., 2021).©RichardOrtega
Dyshoméostasie des métaux et maladies neurodégénératives
Dyshoméostasie du fer et maladie de Parkinson
La perturbation de l’homéostasie du Fe pourrait jouer un rôle important dans la pathogenèse de la maladie de Parkinson par induction de stress oxydant. Nous avons développé une approche expérimentale pour cartographier les éléments chimiques sur des régions de cerveau bien identifiées en utilisant une imagerie corrélative immunohistochimique et élémentaire. Nous avons appliqué cette méthodologie à l’étude d’un modèle animal de la maladie de Parkinson, le rat lésé avec la 6-hydroxydopamine (6-OHDA) (Carmona et al., 2019).
Nous avons constaté que la teneur en fer était plus élevée dans la substantia nigra pars reticulata (SNpr) que dans la pars compacta (SNpc), mais qu’elle n’était pas modifiée par le traitement avec la 6-OHDA. A l’inverse, la teneur en manganèse est plus élevée dans la SNpc par rapport à la SNpr. À l’aide de la micro-spéciation par absorption de rayons X, nous avons identifié les états d’oxydation du Fe dans le SNpr et le SNpc, présentant une similarité spectrale comparable à celle de la ferritine pour toutes les régions du cerveau et les conditions d’exposition.
Cette étude illustre la capacité de corréler l’immunohistochimie et l’imagerie des éléments chimiques au niveau des régions du cerveau et ce protocole peut maintenant être largement appliqué à d’autres études sur la dyshoméostasie des métaux en neurologie.
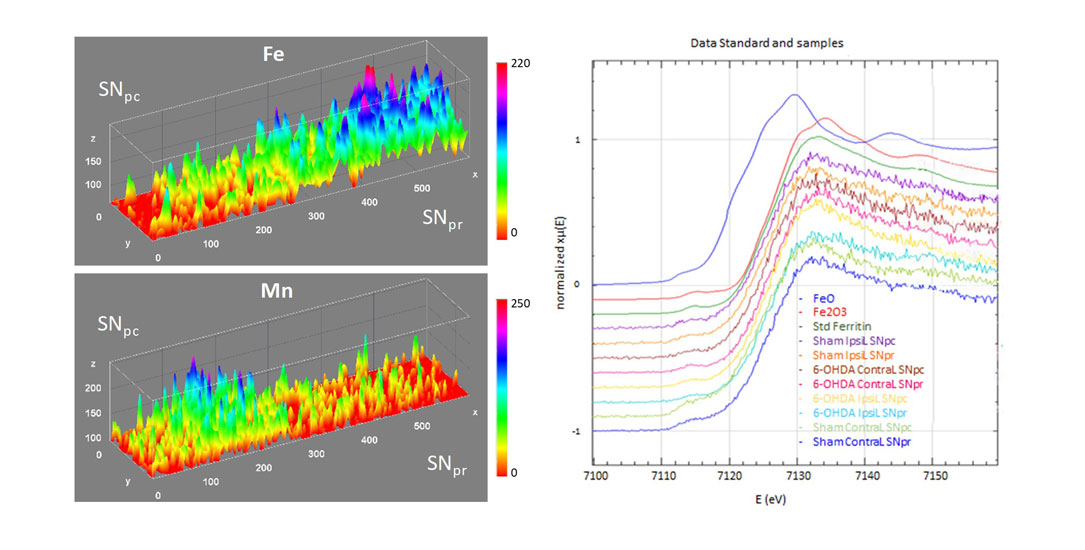
Imagerie du fer (Fe) et du manganèse (Mn) dans les deux compartiments de la substantia nigra (SNpc et SNpr) montrant la distribution opposée de ces deux éléments dans chacun des compartiments. La micro-spéciation par absorption de rayons X (ligne de lumière LUCIA, SOLEIL) montre que le fer est présent sous forme Fe(III), sous une forme spectrale comparable à celle de la ferritine (Carmona et al., 2019)©RichardOrtega
Agrégation de la superoxyde dismutase à Cu et Zn et maladies neurodégénératives
L’objet de l’étude en cours est la détermination du rapport Cu/Zn de la superoxyde dismutase à Cu/Zn (SOD1) impliquées dans la sclérose latérale amyotrophique (SLA) et la maladie de Parkinson.
L’approche mise en œuvre implique le couplage de méthodes de séparation des protéines telle que l’électrophorèse non dénaturante sur gel de polyacrylamide avec l’analyse par faisceau d’ions ou par rayonnement synchrotron (Roudeau, 2021).
Nous avons participé à la mise en évidence d’agrégats de SOD1 dans le cerveau de patients parkinsoniens (Trist et al., 2017) en collaboration avec les équipes de Kay Double (Université de Sydney) et Dominic Hare (Université de Melbourne). Ces agrégats sont associés à la mort des neurones mais ils sont différents des agrégats typiques d’alpha-synucléine bien connus dans la maladie de Parkinson. Résultat inattendu, ils sont similaires aux inclusions de SOD1 retrouvées dans les motoneurones de cas familiaux de SLA.
Dans le cas de la maladie de Parkinson, les analyses de la SOD1 ont montré une augmentation du point isoélectrique de l’enzyme (équivalent à une diminution de la charge nette), une conformation anormale et un déficit partiel de Cu dans les dépôts SOD1. Ces données suggèrent donc l’existence d’un mécanisme toxique commun aux deux pathologies, SLA et Parkinson, via la formation d’agrégats toxiques de SOD1.


